A tabela periódica dos elementos, em química, trata-se do arranjo organizado de todos os elementos químicos em ordem crescente de número atômico – isto é, o número total de prótons no núcleo atômico. Quando os elementos químicos são assim organizados, há um padrão recorrente chamado de “lei periódica” em suas propriedades, em que elementos na mesma coluna (grupo) têm propriedades semelhantes. A descoberta inicial, que foi feita por Dmitry I. Mendeleyev em meados do século 19, tem sido de valor inestimável para o desenvolvimento da química.
Não foi reconhecido até a segunda década do século XX que a ordem dos elementos no sistema periódico é a de seus elementos. Nos anos seguintes, grandes progressos foram feitos na explicação da lei periódica em termos da estrutura eletrônica de átomos e moléculas. Esse esclarecimento aumentou o valor da lei, que é usada tanto hoje quanto no início do século XX, quando expressou a única relação conhecida entre os elementos.

Qual é a História da Tabela Periódica?
Os primeiros anos do século XIX testemunharam um rápido desenvolvimento da química analítica – a arte de distinguir diferentes substâncias químicas – e a conseqüente construção de um vasto corpo de conhecimento das propriedades químicas e físicas de ambos os elementos e compostos. Essa rápida expansão do conhecimento químico logo exigiu classificação. As classificações do conhecimento químico baseiam-se não só a literatura sistematizada de química, mas também as artes de laboratório pelo qual a química é transmitida como uma ciência viva de uma geração de químicos para outro. Relacionamentos foram discernidos mais prontamente entre os compostos do que entre os elementos; Ocorreu, assim, que a classificação dos elementos ficou muito atrasada em relação aos compostos. De fato, nenhum acordo geral foi alcançado entre os químicos quanto à classificação dos elementos por quase meio século após os sistemas de classificação de compostos terem se estabelecido em uso geral.
JW Döbereiner em 1817 mostrou que o peso combinando, significando peso atômico, de estrôncio fica a meio caminho entre os de cálcio e bário, e alguns anos depois ele mostrou que outros existem (cloro, bromo e iodo [halogênios] e lítio , sódio e potássio [metais alcalinos]). J.-B.-A. Dumas, L. Gmelin, E. Lenssen, Max Von Pettenkofer e JP Cooke expandiram as sugestões de Döbereiner entre 1827 e 1858, mostrando que relações semelhantes se estendiam além das tríades de elementos, sendo o flúor adicionado aos halogênios e magnésio à alcalina-terra. Metais, oxigênio, enxofre, selênio e telúrio foram classificados como uma família e nitrogênio, fósforo, arsênico, antimônio e bismuto como outra família de elementos.

Classificação dos Elementos da Tabela Periódica
Em 1864, JAR Newlands propôs a classificação dos elementos na ordem de aumento dos pesos atômicos, os elementos sendo atribuídos números ordinais da unidade para cima e divididos em sete grupos com propriedades estreitamente relacionadas aos primeiros sete dos elementos então conhecidos: hidrogênio, lítio, berílio, boro, carbono, nitrogênio e oxigênio. Essa relação foi denominada lei das oitavas, por analogia com os sete intervalos da escala musical.
Então, em 1869, como resultado de uma extensa correlação das propriedades e os pesos atômicos dos elementos, com especial atenção para Valência (isto é, o número de ligações simples que o elemento pode formar), Mendeleyev propôs a lei periódica, segundo a qual “os elementos organizados de acordo com a magnitude dos pesos atômicos mostram uma mudança periódica de propriedades”.Lothar Meyer chegou independentemente a uma conclusão semelhante, publicada após o aparecimento do artigo de Mendeleyev.
O grande valor da lei periódica foi evidenciado pelo sucesso de Mendeleyev em 1871 ao descobrir que as propriedades de 17 elementos poderiam ser correlacionadas com as de outros elementos, movendo as 17 para novas posições daquelas indicadas por seus pesos atômicos. Esta mudança indicou que houve pequenos erros nos pesos atômicos previamente aceitos de vários dos elementos e grandes erros para vários outros, para os quais múltiplos errados dos pesos de combinação foram usados como pesos atômicos (o peso de combinação sendo aquele peso de um elemento que combina com um determinado peso de um padrão). Mendeleyev também foi capaz de prever a existência, e muitas das propriedades, dos elementos então desconhecidos eka-boro, eka-alumínio e eka-silício, agora identificados com os elementos escândio ,gálio e germânio, respectivamente. Da mesma forma, após a descoberta do hélio e do argônio, a lei periódica permitiu a previsão da existência de néon, criptônio, xenônio e radônio. Além disso, Bohr apontou que o elemento ausente 72 seria esperado, a partir de sua posição no sistema periódico, para ser semelhante ao zircônio em suas propriedades e não às terras raras; essa observação levou G. de Hevesy e D. Coster em 1922 a examinar minérios de zircônio e a descobrir o elemento desconhecido, que eles denominaram háfnio.
Períodos da Tabela Periódica
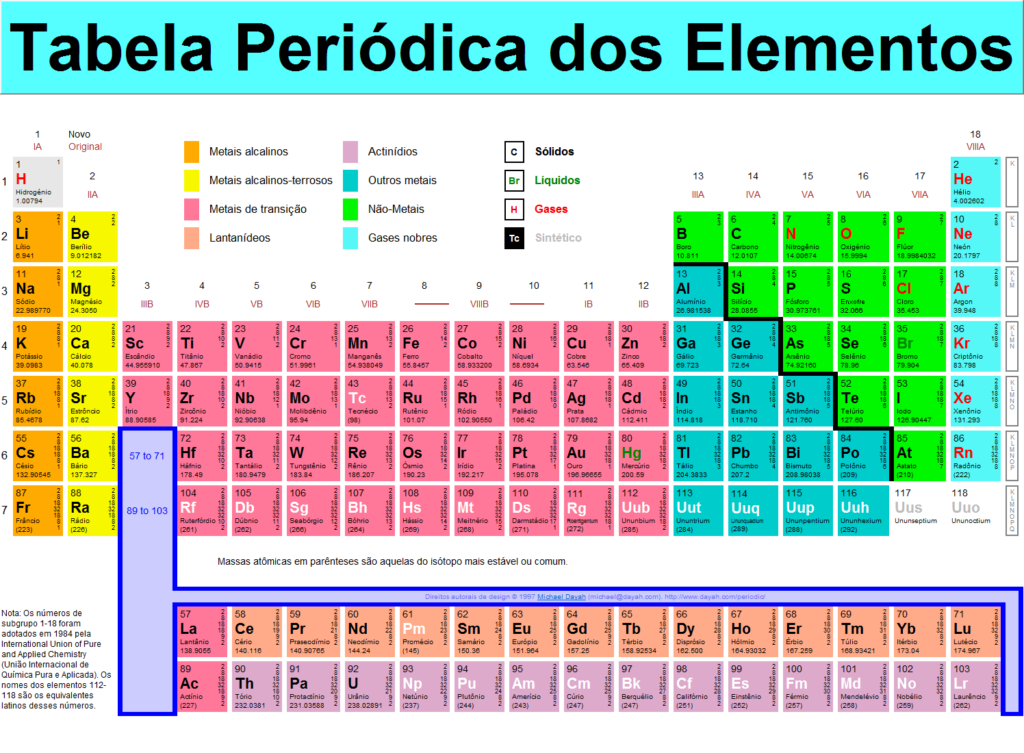
A tabela periódica dos elementos contém todos os elementos químicos que foram descobertos ou feitos; estão dispostas, na ordem de seus números atômicos, em sete períodos horizontais, com os lantânoides (lantânio, 57, lutécio, 71) e os actinoides (actínio, 89, a lawrencium, 103) indicados separadamente abaixo (a menos que indicado de outra forma) , A Figura 1 será usada como referência). Os períodos são de comprimentos variados. Primeiro, há o período de hidrogênio, consistindo dos dois elementos hidrogênio, 1 e hélio, 2. Então, há dois períodos de oito elementos cada: o primeiro período curto, do lítio, 3, para o neon, 10; e o segundo curto período, de sódio, 11, para argônio, 18. Seguem-se dois períodos de 18 elementos cada: o primeiro período longo, do potássio 19, ao criptônio, 36; e o segundo longo período, de rubídio, 37, para xenônio, 54. O primeiro período muito longo de 32 elementos, de césio, 55, a radônio, 86, é condensado em 18 colunas pela omissão dos lantanóides (que são indicados separadamente abaixo), permitindo que os 18 elementos remanescentes, que são muito semelhantes em suas propriedades aos elementos correspondentes do primeiro e do segundo longos períodos, sejam colocados diretamente abaixo desses elementos. O segundo período muito longo, do francium, 87, para oganésson , 118, é igualmente condensado em 18 colunas pela omissão dos actinóides.

Classificação dos Elementos em Grupos
Os seis gases nobres – hélio, néon, argônio, criptônio, xênon e radônio – ocorrem nas extremidades dos seis períodos concluídos e constituem o grupo 18 (0) do sistema periódico. Costuma-se referir a série horizontal de elementos na tabela como períodos e séries verticais como grupos. Os sete elementos lítio a flúor e os sete elementos correspondentes sódio a cloro são colocados, na Figura 1 , nos sete grupos, 1 (Ia), 2 (IIa), 13 (IIIa), 14 (IVa), 15 (Va) , 16 (VIa) e 17 (VIIa), respectivamente. Os 17 elementos do quarto período, do potássio, 19, ao bromo, 35, são distintos em suas propriedades e são considerados como constituindo os Grupos 1-17 (Ia-VIIa) do sistema periódico.
O primeiro grupo, o metais alcalinos , incluem, assim, além do lítio e do sódio, os metais do potássio na mesa até o frâncio, mas não os metais muito menos similares do Grupo 11 (Ib; cobre , etc.). Também o segundo grupo, considera -se que os metais alcalino-terrosos incluem berílio , magnésio , cálcio , estrôncio , bário e rádio, mas não os elementos do grupo 12 (IIb). O grupo do boro inclui esses elementos no Grupo 13 (IIIa). Os outros quatro grupos são os seguintes: o grupo carbono , 14 (IVa), consiste em carbono, silício , germânio , estanho , chumbo e fleróvio; agrupo nitrogênio , 15 (Va), inclui nitrogênio, fósforo , arsênico , antimônio , bismuto e moscovium; o grupo de oxigênio , 16 (VIa), inclui oxigênio, enxofre , selênio , telúrio , polônio e fígado orgânico; e agrupo halogénio , 17 (VIIa), inclui flúor, cloro, bromo, iodo , astatina e tennessina.

Embora o hidrogênio esteja incluído no Grupo 1 (Ia), ele não é muito semelhante aos metais alcalinos ou aos halogênios em suas propriedades químicas. É, no entanto, atribuído o número de oxidação +1 em compostos tais como fluoreto de hidrogio, HF e -1 em compostos tais como hidreto de lio, LiH; e pode, portanto, ser considerado semelhante a um elemento do Grupo 1 (Ia) e a um elemento do Grupo 17 (VIIa), respectivamente, em compostos desses dois tipos, tomando o primeiro lugar de Li e então de F em fluoreto de lítio, LiF O hidrogênio é, de fato, o mais individualista dos elementos: nenhum outro elemento se assemelha à forma como o sódio se assemelha ao lítio, o cloro se assemelha ao flúor e o neon se parece com o hélio. É um elemento único, o único elemento que não pode ser convenientemente considerado um membro de um grupo.
Vários elementos de cada longo período são chamados de metais de transição. Estes são geralmente considerados como escândio, 21, para zinco, 30 (os metais de transição do grupo de ferro); ítrio, 39, a cádmio, 48 (os metais de transição do grupo paládio); e háfnio, 72, a mercúrio, 80 (os metais de transição do grupo da platina). Por esta definição, os metais de transição incluem os Grupos 3 a 12 (IIIb a VIIIb, e Ib e IIb).
Cada tabela na tabela contém os dados para um elemento químico: símbolo, massa atômica, número atômico, nome do elemento, elétrons nas camadas e se o elemento é radioativo.As linhas horizontais são chamadas de pontos. Neles, os elementos químicos são dispostos em ordem crescente de seus números ordinais. O número do pedido de período indica o número de níveis de energia ou camadas eletrônicas do elemento.

Como Utilizar a Tabela Periódica?
A tabela periódica contém sete períodos:
1º período – 2 elementos
2º período – 8 elementos
3º período – 8 elementos
4º período – 18 elementos
5º período – 18 elementos
6º período – 32 elementos
7º período – 32 elementos
As colunas verticais representam as famílias ou grupos nos quais os elementos são reunidos de acordo com suas propriedades químicas.
Famílias ou grupos variam de 1 a 18. Algumas famílias têm um nome como:
1 – alcalina
2 – alcalino da terra
13 – Borfamilie
14 – família de carbono
15 – família de nitrogênio
16 – Família de Calcogênicos
17 – Família dos halogênios
18 – gases nobres
Da família 1 e 2 e 13 a 18, nos referimos aos elementos representativos. Da Família 3 a 12, chamamos elementos de transição.
Os elementos que permanecem na série de lantanídeos e actinídeos são os elementos de transição. Como eles estão no Grupo 3 como se estivessem em uma “caixa” dentro da tabela, eles são chamados de itens de transição internos. Os outros são chamados de elementos de transição externos.